Cấu hình electron nguyên tử là một phần quan trọng của môn Hóa học lớp 10 và sau đó là lớp 11, 12. Tuy nhiên, một số học sinh vẫn chưa hiểu và nắm rõ phần này. Hãy cùng Trường ĐH Đại Việt Sài Gòn tìm hiểu ngay chi tiết cấu hình nguyên tử của từng nguyên tố dưới đây nhé. Đảm bảo sẽ giúp bạn học một cách nhanh chóng và hiệu quả. Bởi vì chúng tôi đã kiếm tiền để xây dựng tất cả 118 nguyên tố hóa học trong bảng tuần hoàn các nguyên tố hóa học.
Cuộc cách mạng điện tử nguyên tử cuối cùng 2023
Cấu hình electron của nguyên tử là quá trình phân bố electron giữa các bộ phận và thành phần của nguyên tử. Cấu hình electron xác định cấu trúc của một nguyên tử, bao gồm khả năng hình thành liên kết hóa học với các nguyên tử khác.
Cấu hình electron của một nguyên tử được viết dưới dạng số lượng electron trong mỗi lớp và vùng electron. Ví dụ, cấu hình electron của nguyên tử hydro (H) là 1s1, nghĩa là có một electron ở lớp vỏ và vùng s. Cấu hình electron của nguyên tử cacbon (C) là 1s2 2s2 2p2, nghĩa là có 2 electron ở lớp và vùng s, 4 electron ở lớp và vùng p.
Cấu hình electron của một nguyên tử có thể được xác định bằng nhiều phương pháp, bao gồm việc sử dụng bảng tuần hoàn các nguyên tố hóa học và định luật khối lượng như quy tắc Hund và quy tắc Klechkowski. Động lực học electron của một nguyên tử cũng có thể được tính toán bằng các phương pháp lý thuyết như phương trình Schrödinger và phương pháp electron.
Các thành phần của cấu hình electron của một nguyên tử là gì?
Cấu hình electron hay cấu hình của nguyên tử được hiểu là sự phân bố của các electron trong vỏ nguyên tử ở các trạng thái năng lượng khác nhau hoặc trong các trường khả dụng.

-> Xem thêm: Bảng tuần hoàn Hóa học
Chúng ta có thể coi nguyên tử là một hạt nhỏ có đường kính khoảng 0,00000001 cm, được tạo thành từ các proton, neutron và electron (e). Trong đó, các electron được tạo ra, được chia thành các nhóm tăng năng lượng và theo thứ tự s, p, d, f.
Ví dụ: Sự chuyển dời electron trong một số nguyên tố đã biết
| nguyên tố hóa học | z | thay đổi e |
| Al | 13 | 1s2 2s2 2p6 3s2 3p1 |
| KYC | 19 | 1s2 2s2 2p6 3s2 3p6 4s1 |
| Fe | 26 | 1s22s22p63s23p63d64s2 |
| ĐẾN | 29 | 1s22s22p63s23p63d94s2 |
Do đó, cấu hình electron của nguyên tử là dãy số biểu thị các obitan của electron. Do cấu hình electron, bạn có thể nhanh chóng xác định số lượng quỹ đạo electron trong một nguyên tử và số lượng electron trong mỗi loại.
lớp học điện tử
Khi nói đến vỏ điện tử, bạn cần nhớ những điểm quan trọng sau:
- Các electron trong cùng một lớp vỏ có cùng năng lượng
- Trong mỗi lớp vỏ electron có thể có một hoặc nhiều AO.
- Năng lượng của electron phụ thuộc vào khoảng cách từ electron đến hạt nhân. Electron càng xa hạt nhân thì năng lượng càng cao
Số AO và số electron ở mỗi lớp như sau:
| Lớp học | K (n = 1) | L (n = 2) | M (n = 3) | N (n = 4) |
| Số lượng hồ bơi | Trước hết | 4 | 9 | 16 |
| Số electron càng lớn | 2 | số 8 | 18 | 32 |
– Số electron và số AO ở lớp vỏ thứ n (n £ 4) được ghi nhớ theo quy tắc sau:
- Ô thứ n có n2 AO
- Lớp thứ n có nhiều hơn 2n2 electron
vỏ điện tử
Mỗi lớp electron ngoại trừ lớp đầu tiên được chia thành các lớp con theo nguyên tắc: Các electron trong cùng một lớp có cùng năng lượng.
-Số và ký hiệu của các phân lớp trong lớp: Lớp electron thứ n có các phân lớp và được ký hiệu là ns, np, nd, nf,… Cụ thể như sau:
- Lớp K (n=1): có 1 phân nhóm, ký hiệu là 1s
- Lớp L (n= 2): có 2 nhóm, đại diện cho 2s và 2p
- Lớp M (n=3): có 3 nhóm, đại diện cho 3s, 3p và 3d
– Số lượng AO mỗi loại:
- Phân lớp ns chỉ có 1 AO
- Phân lớp np có 3 AO
- Phân lớp nd có 5 AO
- Phân lớp nf có 7 AO
– Số lượng electron trong mỗi lớp con được biểu thị bằng số ở trên, bên phải ký hiệu lớp con. Một lớp con có nhiều electron hơn được gọi là lớp con bão hòa.
– Số electron tối đa trong mỗi phân lớp
| Phân lớp ns chứa hai electron | Phân lớp thứ hai chứa 10 electron |
| Phân lớp Np có 6 electron | Phân lớp Nf có 14 electron |
Sự sắp xếp các mức năng lượng trong nguyên tử
Nếu cùng một phân lớp, các electron ở các quỹ đạo khác nhau có cùng mức năng lượng. Các mức năng lượng nguyên tử được sắp xếp theo chiều dọc.
Trên Trái đất, các electron trong nguyên tử được tích điện tương ứng từ thấp đến cao.
Từ bên trong, sức mạnh của các nhóm tăng từ 1 đến 7. Sức mạnh của các phần lần lượt là s, p, d, f. (1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p)
Chú ý: Khi điện tích hạt nhân tăng thì có sự xác định mức năng lượng sao cho năng lượng của 4s nhỏ hơn năng lượng của 3d.
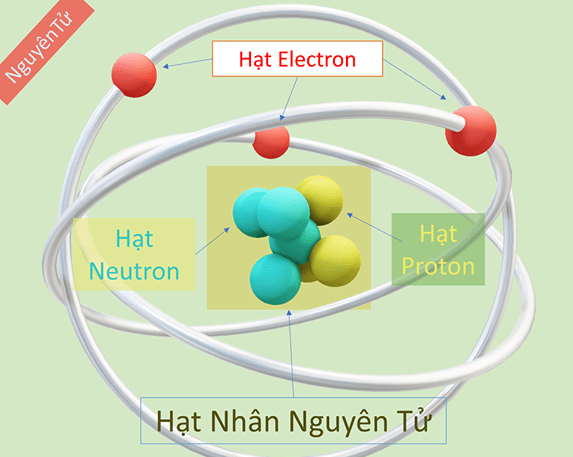
Quy tắc viết cấu hình electron đúng của nguyên tử
Để viết cấu hình electron, trước tiên chúng ta cần biết các nguyên tắc và quy tắc sau:
+ Nguyên lý Pauli: Trong một obitan nguyên tử chỉ có thể có 2 electron và 2 electron này quay quanh nhau theo những hướng khác nhau xung quanh mỗi electron.
+ Quy tắc Hund: Trong cùng một phân lớp, các electron sẽ phân bố trên các obitan sao cho số electron độc thân nhiều và các electron phải có quỹ đạo giống nhau.
+ Nguyên tắc cơ bản: Về cơ bản, trong nguyên tử, các electron có các quỹ đạo có năng lượng tương ứng từ thấp đến cao.
Quá trình chuyển đổi điện tử thể hiện sự phân bố của các điện tử trong các lớp và lớp con. Vì vậy, khi bạn viết, bạn tuân theo các quy tắc sau:
– Quy tắc 1: Điền các electron theo thứ tự mức năng lượng từ thấp đến cao (dãy Klechkovski):
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s…
Đó là, bạn điền vào lớp con điện tử trước rồi điền vào lớp con tiếp theo.
– Quy tắc 2: Sắp xếp lại các nhóm con sao cho số lớp (n) tăng dần từ trái sang phải, các nhóm con trong cùng một lớp theo thứ tự s, p, d, f.
Ví dụ: Một nguyên tử Fe có Z=26. Nếu bạn lấp đầy chuỗi Klechkovski bằng các electron, bạn sẽ nhận được chuỗi không hoàn chỉnh 1s22s22p63s23p64s23d6. Bạn cũng đang đổi chỗ các phân lớp 4s2 và 3d6 để có cấu hình electron 1s22s22p63s23p63d64s2.
Sự chuyển đổi electron phản ánh sự sắp xếp của các electron năng lượng giữa các lớp con. Năng lượng electron trong mỗi lớp con tăng dần từ trái sang phải.
Ví dụ: Cấu hình electron của nguyên tử oxi là 1s22s22p4. Trong một nguyên tử oxy, năng lượng của một electron trong lớp con 2s cao hơn năng lượng của một electron trong lớp con 1s. Năng lượng của các electron trong lớp con 2p cao hơn năng lượng của các electron trong lớp con 2s.
-> Xem thêm: Dãy điện hóa của kim loại
Cách viết cấu hình electron đúng của nguyên tử
Có được thông tin trên, nhiệm vụ tiếp theo là viết cấu hình electron nguyên tử đơn giản và dễ nhớ.
- Bước 1: Đầu tiên, bạn biết mật độ electron của nguyên tử.
- Bước 2: Sau đó sắp xếp các electron theo mức năng lượng tăng dần theo quy tắc: 1s 2s 2p 3s 3p 4s 3d 4p 5s…
- Bước 3: Sắp xếp từng phần theo thứ tự (1→7). Trong mỗi lớp, lập kế hoạch thứ tự của từng loại (s → p → d → f). Ví dụ: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s…
Lưu ý khi viết cấu hình electron:
- Bạn cần biết chính xác số electron của một nguyên tử hoặc ion (Số electron (e) = số proton (n) = Z).
- Điều quan trọng là phải hiểu các quy tắc và quy định của lớp học và nhóm
- Độ bão hòa và bán bão hòa ở d, và cấu hình electron ổn định khi các electron lấp đầy phân lớp 4 đạt đến độ bão hòa (d, f) hoặc bán bão hòa (d, f).
– Ví dụ: Viết cấu hình electron của các nguyên tố sau: Na (Z=11)
- Bước 1: Xác định E = Z = 11
- Bước 2: Sắp xếp các electron theo thứ tự tăng dần: 1s2 2s2 2p6 3s1
- Bước 3: Viết cấu hình electron: 1s2 2s2 2p6 3s1.
 Kiểm soát đường chéo của Klechkovski . loạt
Kiểm soát đường chéo của Klechkovski . loạt
Cách biểu diễn cấu hình electron trên obitan
Biểu diễn cấu hình electron obitan hay còn gọi là biểu diễn cấu hình ô lượng tử là cách biểu diễn sự phân bố electron dọc theo các obitan. Từ đó bạn sẽ biết nguyên tử có bao nhiêu electron độc thân, electron nào có 1 obitan đó.
Quy tắc cần nhớ khi biểu diễn cấu hình electron trên obitan:
– Quy tắc 1: Viết cấu hình electron của nguyên tử
– Quy tắc 2: Biểu diễn mỗi AO bằng một ô vuông (quỹ đạo hoặc đồ thị lượng tử). Đối với các AO cùng hạng thì ghi cẩn thận. Các AO khác ít hơn được ghi riêng. Sắp xếp các obitan từ trái sang phải theo thứ tự chuyển động của các electron.
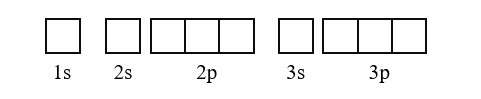
– Quy tắc 3: Liệt kê các electron trong mỗi ô obitan theo lớp và phân lớp, mỗi electron được biểu diễn bằng mũi tên.
Ghi chú:
- Trong mỗi lớp con, các electron được phân bố sao cho số lượng electron chưa ghép cặp lớn. Các electron được điền vào quỹ đạo từ trái sang phải.
- Trong biểu đồ quỹ đạo, electron đầu tiên được biểu thị bằng mũi tên hướng lên, electron thứ hai bằng mũi tên hướng xuống.
Ví dụ:
- Một nguyên tử O (Z = 8) có cấu hình nguyên tử là 1s2 2s2 2p4.
- Sự sắp xếp quỹ đạo của O như sau
Do đó, một nguyên tử oxy có hai electron độc thân, AO 2p.
Ngoài ra bạn nên biết rằng electron mang điện tích âm nên 2 electron trong cùng AO sẽ đẩy nhau. Chúng có xu hướng tách ra và trở thành hai AO khác nhau. Vì vậy, trong phân lớp các electron cần được sắp xếp sao cho số lượng electron độc thân lớn.
Dự đoán hóa học dựa trên cấu hình electron
Chuyển đổi điện tử đóng một vai trò quan trọng trong cấu trúc hóa học của một nguyên tố. Từ sự thay đổi này, bạn dự đoán theo quy tắc này:
– Quyết định 1:
Nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng thường là nguyên tử kim loại. Tính chất của kim loại được đặc trưng bởi khả năng tặng electron trong các phản ứng hóa học (khử).
Ví dụ: Nguyên tử Na (Z = 11) có 1 electron ở lớp ngoài cùng nên Na là nguyên tố kim loại.
– Quyết định 2:
Các nguyên tử có 5, 6 hoặc 7 electron ở lớp vỏ ngoài cùng thường là những nguyên tử không bền. Một phi kim được đặc trưng bởi khả năng nhận electron trong các phản ứng hóa học (sự oxi hóa).
Ví dụ: Nguyên tử O (Z=8) có 6 electron ở lớp ngoài cùng nên O là nguyên tố không bay hơi.
– Khoản 3:
Các nguyên tử có 8 electron ở lớp ngoài cùng (trừ He chỉ có 2 electron) là các nguyên tử khí hiếm. Các vật này khó tham gia biến đổi cơ học (tính trơ).
Ví dụ: Nguyên tử Ne (Z = 10) có 8 electron ở lớp ngoài cùng nên Ne là khí hiếm.
– Khoản 4:
Nếu lớp electron của nguyên tử có 4 electron thì nguyên tử của nguyên tố đó có thể là kim loại hoặc phi kim.
Kết thúc
Vậy là bạn đã hiểu cấu hình electron được hình thành như thế nào. Quy tắc viết cấu hình electron chính xác nhất. Hơn nữa, dựa trên cấu hình này, các thuộc tính của sản phẩm có thể được dự đoán. Hi vọng những thông tin trên sẽ giúp các bạn học tốt môn Hóa hơn.
Bạn thấy bài viết Cấu Hình Electron Nguyên Tử Chuẩn Xác Nhất 2023 có khắc phục đươc vấn đề bạn tìm hiểu ko?, nếu ko hãy comment góp ý thêm về Cấu Hình Electron Nguyên Tử Chuẩn Xác Nhất 2023 bên dưới để Trường TH Đông Phương Yên có thể thay đổi & cải thiện nội dung tốt hơn cho các bạn nhé! Cám ơn bạn đã ghé thăm Website: daihocdaivietsaigon.edu.vn của Trường TH Đông Phương Yên
Nhớ để nguồn bài viết này: Cấu Hình Electron Nguyên Tử Chuẩn Xác Nhất 2023 của website daihocdaivietsaigon.edu.vn
Chuyên mục: Kinh nghiệm hay
Tóp 10 Cấu Hình Electron Nguyên Tử Chuẩn Xác Nhất 2023
#Cấu #Hình #Electron #Nguyên #Tử #Chuẩn #Xác #Nhất
Video Cấu Hình Electron Nguyên Tử Chuẩn Xác Nhất 2023
Hình Ảnh Cấu Hình Electron Nguyên Tử Chuẩn Xác Nhất 2023
#Cấu #Hình #Electron #Nguyên #Tử #Chuẩn #Xác #Nhất
Tin tức Cấu Hình Electron Nguyên Tử Chuẩn Xác Nhất 2023
#Cấu #Hình #Electron #Nguyên #Tử #Chuẩn #Xác #Nhất
Review Cấu Hình Electron Nguyên Tử Chuẩn Xác Nhất 2023
#Cấu #Hình #Electron #Nguyên #Tử #Chuẩn #Xác #Nhất
Tham khảo Cấu Hình Electron Nguyên Tử Chuẩn Xác Nhất 2023
#Cấu #Hình #Electron #Nguyên #Tử #Chuẩn #Xác #Nhất
Mới nhất Cấu Hình Electron Nguyên Tử Chuẩn Xác Nhất 2023
#Cấu #Hình #Electron #Nguyên #Tử #Chuẩn #Xác #Nhất
Hướng dẫn Cấu Hình Electron Nguyên Tử Chuẩn Xác Nhất 2023
#Cấu #Hình #Electron #Nguyên #Tử #Chuẩn #Xác #Nhất