Không khí là kim loại màu có nhiều công dụng trong đời sống, có thể điều chế bằng nhiều cách khác nhau không? Vậy nguyên tố cacbon là gì? Các ứng dụng và quá trình vật lý, hóa học hoặc các ứng dụng và quá trình khác của nguyên tố carbon trong phòng thí nghiệm, trong cuộc sống hàng ngày là gì? Để trả lời câu hỏi trên, hãy cùng Trường ĐH Đại Việt Sài Gòn tìm hiểu qua bài viết dưới đây nhé!

nguyên tố cacbon là gì
Cacbon là một nguyên tố hóa học có nguồn gốc từ tiếng Pháp carbone, có ký hiệu hóa học là C. Nó là một nguyên tố phổ biến có hóa trị IV. Phần này cũng có nhiều tính năng
Không khí, chủ yếu được tìm thấy trong tất cả các sinh vật sống, là nền tảng của hóa học hữu cơ. Đây là một loại phi kim đặc biệt, nó có thể kết hợp với chính nó và có thể kết hợp với nhiều thứ khác, có khoảng 10 triệu loại đã biết.
- Không khí là kim loại màu
- Biểu tượng:
- Cấu hình electron: 1s22s22p2
- Số nguyên tử: Z = 6
- Khối lượng nguyên tử: 12
Vị trí trong bảng tuần hoàn
- Ô, nhóm: ô số 6, nhóm IVA
- tròn: 2
- Đồng vị: Carbon có hai đồng vị ổn định là 126C và 136C.
- Hệ số công suất: 2,55
Lịch sử của nguyên tố cacbon
Ít ai nghĩ rằng carbon dioxide (CF) được phát minh vào năm 1879 bởi Thomas Edison và được coi là một trong những kim loại lâu đời nhất do con người tạo ra, mang lại lợi ích to lớn như vậy cho sự phát triển của loài người. Lúc đầu, nhà phát minh sử dụng sợi carbon để làm bóng đèn. Mặc dù sợi carbon không giống như sợi carbon ngày nay, nhưng nó có khả năng chịu nhiệt cực cao, điều này cũng khiến sợi carbon trở thành một ý tưởng hay cho sợi dẫn điện.
Edison là người đã tạo ra sợi carbon dựa trên cellulose làm từ bông hoặc tre, rất khác với sợi carbon làm từ dầu mỏ ngày nay. Quá trình cacbon hóa thường được thực hiện bằng cách đốt sợi tre ở nhiệt độ cao trong môi trường ổn định dưới sự kiểm soát chặt chẽ. Thomas Edison cũng đã dành 40 giờ liên tục đốt cháy vật chất để loại bỏ oxy, nitơ, hydro và giữ lại sợi carbon đầu tiên trên thế giới. Phương pháp sản xuất này được gọi là “nhiệt phân” và vẫn được sử dụng cho đến ngày nay. Kết quả là sợi tre được “cacbon hóa” có khả năng chống cháy và nhiệt độ cao, cần thiết cho quá trình đốt cháy dây tóc của bóng đèn.
Sau đó, mãi đến những năm 1950, độ bền kéo của sợi carbon mới được biết đến. Người đầu tiên được cho là đã tạo ra carbon dioxide hiện được gọi là Rayon. Ngày nay, sợi carbon hiện đại được làm từ một vật liệu có tên là polyacrylonitrile (PAN), chất liệu này cũng được sử dụng để sản xuất rất nhiều sợi carbon.
cơ thể carbon
Carbon vật lý cũng phụ thuộc vào hình thức của nó. Ví dụ, kim cương không thể dẫn điện, nhưng than chì – một loại carbon – dẫn điện tốt.
Trong đó, các dạng thù hình của cacbon được phân loại theo từng dạng mà chúng mang như sau:
thân kim cương
Người ta thường dùng kim cương vì nó có giá trị cao, rất cứng, màu đẹp. Một số tính năng quan trọng của cấu tạo carbon là:
Cấu trúc tinh thể: Tinh thể có dạng lập phương nên cấu hình cao, có các nguyên tử cacbon bậc 4 nên có nhiều tính chất riêng. Khối lượng riêng của kim cương là 3,50 g/cm3.
Độ cứng: Kim cương là nguyên tố cứng nhất xuất hiện tự nhiên và có giá trị nhất trong số hơn 3.000 nguyên tố mà con người biết đến. Đây là lý do tại sao các công ty đã sử dụng kim cương trong một thời gian dài.
Độ giòn: Kim cương được các nhà hóa học coi là giòn.
Màu sắc: Màu sắc của kim cương cũng rất đa dạng, từ những viên kim cương không màu, xanh dương, xanh lục, đỏ, hồng, vàng hay đen.
Tính chất vật lý của than chì
Than chì có màu xám và dẫn điện tốt, nhưng không tốt bằng sắt. Than chì thường có cấu trúc phân lớp nên mềm, khi cọ xát trên giấy để lại những vệt sẫm màu với nhiều lớp tinh thể.
Đặc điểm của carbon vô định hình
Không khí vô định hình sẽ bao gồm nhiều loại như than gỗ, bồ hóng, than xương… Loại than này cũng xốp nên hấp thụ nhiều không khí và các chất hòa tan trong dung dịch.
Tính chất hóa học của cacbon
Phản ứng hóa học: kim cương
C vừa là chất khử vừa là chất oxi hóa
Giảm cân
Cacbon bị khử khi đun nóng:
![]()
Ở nhiệt độ cao:
![]()
khử oxit kim loại
– C khử yếu oxit sắt, trung bình (ZnO → CuO)
2ZnO + C 2Zn + CO2
2CuO + C 2Cu + CO2
– C khử được oxit kim loại mạnh
2CuO + C 2Cu + CO2
khử nước
C + H2O CO2 + H2
CO2 + C2CO
Khử một số hóa chất oxy hóa rắn
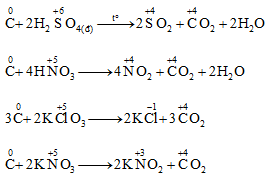
điều chế carbon
Mỗi loại carbon cũng sẽ có phương pháp xử lý riêng:
Kim cương: Điều chế kim cương tổng hợp bằng cách nung than chì ở nhiệt độ khoảng 2.000 độ C, áp suất từ 50 đến 100 nghìn atm, và chất xúc tác là sắt, niken hoặc crom.
Than cốc: Đốt than trong lò không có không khí, nấu ở nhiệt độ cao khoảng 2.000 độ C. Quá trình tính toán làm bay hơi hoặc phân hủy các chất hữu cơ trong than, tạo ra sản phẩm. khí đốt và nhựa than đá. Than cốc là sản phẩm dễ bay hơi của quá trình phân hủy, cacbon và cặn khoáng liên kết với nhau bằng các hạt than ở dạng hơi, rắn và thủy tinh.
Than chì: Điều chế than chì nhân tạo bằng cách nung than cốc ở nhiệt độ 2.500 – 3.000 độ C trong lò điện không có không khí.
Than củi: Đốt củi không có không khí.
tiêu thụ carbon
CH4 Tính chất hóa học Cacbon (C) | Tính chất vật lý, nhận biết, điều chế, sử dụng Cacbon đen (C) + 2H2
Gỗ Tính chất hóa học của Carbon (C) | Tính chất vật lý, phát hiện, điều chế, sử dụng Than củi (C) Tùy theo dạng thù hình của mỗi loại cacbon mà chúng có những ứng dụng khác nhau trong đời sống, sản xuất hay kỹ thuật. Một số cách sử dụng phổ biến nhất cho từng loại carbon là:
Kim cương: Nó được sử dụng để làm đồ trang sức khác thường, máy khoan, cưa, dao cắt kính, v.v. Kim chịu nhiệt cũng được sử dụng để loại bỏ nhiệt trong các thiết bị điện tử.
Than chì: Được sử dụng rộng rãi trong sản xuất kim loại, vật liệu tổng hợp và vật liệu chịu lửa. Than chì cũng được sử dụng để làm điện cực cho đèn hồ quang, pin, điện cực pin, dầu nhiên liệu, v.v.
Carbon vô định hình: Mỗi dạng carbon vô định hình có một công dụng cụ thể. Chẳng hạn, than hoạt tính dùng để chế tạo mặt nạ phòng độc, khử mùi, khử màu; Than hay gỗ được dùng làm chất đốt trong công nghiệp, chất khử để gia công các kim loại khác…
Kết thúc
Với những thông tin hữu ích mà chúng tôi cung cấp trên đây, hi vọng sẽ giúp những ai quan tâm đến hóa học hiểu rõ hơn về nguyên tố cacbon cũng như cách thức hoạt động, hình dạng, chức năng hay cách điều chế của nó. carbon. Bên cạnh đó, để hiểu rõ hơn về 118 phần tử tại đây.
Bạn thấy bài viết Nguyên tố Cacbon (C), Cấu hình electron, Tính chất hoá học, Vật Lý có khắc phục đươc vấn đề bạn tìm hiểu ko?, nếu ko hãy comment góp ý thêm về Nguyên tố Cacbon (C), Cấu hình electron, Tính chất hoá học, Vật Lý bên dưới để Trường TH Đông Phương Yên có thể thay đổi & cải thiện nội dung tốt hơn cho các bạn nhé! Cám ơn bạn đã ghé thăm Website: daihocdaivietsaigon.edu.vn của Trường TH Đông Phương Yên
Nhớ để nguồn bài viết này: Nguyên tố Cacbon (C), Cấu hình electron, Tính chất hoá học, Vật Lý của website daihocdaivietsaigon.edu.vn
Chuyên mục: Kinh nghiệm hay
Tóp 10 Nguyên tố Cacbon (C), Cấu hình electron, Tính chất hoá học, Vật Lý
#Nguyên #tố #Cacbon #Cấu #hình #electron #Tính #chất #hoá #học #Vật #Lý
Video Nguyên tố Cacbon (C), Cấu hình electron, Tính chất hoá học, Vật Lý
Hình Ảnh Nguyên tố Cacbon (C), Cấu hình electron, Tính chất hoá học, Vật Lý
#Nguyên #tố #Cacbon #Cấu #hình #electron #Tính #chất #hoá #học #Vật #Lý
Tin tức Nguyên tố Cacbon (C), Cấu hình electron, Tính chất hoá học, Vật Lý
#Nguyên #tố #Cacbon #Cấu #hình #electron #Tính #chất #hoá #học #Vật #Lý
Review Nguyên tố Cacbon (C), Cấu hình electron, Tính chất hoá học, Vật Lý
#Nguyên #tố #Cacbon #Cấu #hình #electron #Tính #chất #hoá #học #Vật #Lý
Tham khảo Nguyên tố Cacbon (C), Cấu hình electron, Tính chất hoá học, Vật Lý
#Nguyên #tố #Cacbon #Cấu #hình #electron #Tính #chất #hoá #học #Vật #Lý
Mới nhất Nguyên tố Cacbon (C), Cấu hình electron, Tính chất hoá học, Vật Lý
#Nguyên #tố #Cacbon #Cấu #hình #electron #Tính #chất #hoá #học #Vật #Lý
Hướng dẫn Nguyên tố Cacbon (C), Cấu hình electron, Tính chất hoá học, Vật Lý
#Nguyên #tố #Cacbon #Cấu #hình #electron #Tính #chất #hoá #học #Vật #Lý