Để học tốt Hóa học là môn học phải dựa trên niềm say mê, hứng thú. Một phần nữa mà bạn cần lưu ý, hãy sử dụng bảng tuần hoàn và danh sách các kim loại điện hóa. Dưới đây Trường ĐH Đại Việt Sài Gòn sẽ phân tích chi tiết ý nghĩa và hướng dẫn học điện hóa kim loại đơn giản nhất. Mãi về sau, bạn không cần phải “xoa đầu” mà nhớ lại quãng thời gian đó.
(Bảng Dãy Điện Hóa Của Kim Loại)
Dãy điện hóa của kim loại là gì?
Dãy điện hóa của kim loại (dãy hóa học của kim loại) được định nghĩa là dãy kim loại được sắp xếp trực tiếp theo khả năng phản ứng của kim loại.

Cụ thể, trong tình huống cơ học, liên kết kim loại có thể nhận electron để trở thành nguyên tử kim loại và ngược lại. Nguyên tử kim loại có thể nhường electron để tạo thành cation kim loại.
Ví dụ về các phản ứng hóa học như sau:
- Ku2+ + 2e Ku
- Ag+ + 1e Ag
KẾT LUẬN: Các dạng điện hoá của kim loại chịu tác dụng của phản ứng oxi hoá kim loại là phản ứng làm tăng ion kim loại và khử ion kim loại.
Tính oxi hóa của kim loại tăng dần:
- K+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ H+ Cu2+ Ag+ Au3+
Tính khử của kim loại giảm
- K Na Mg Al Zn Fe Ni Sn Pb H Cu Ag Au
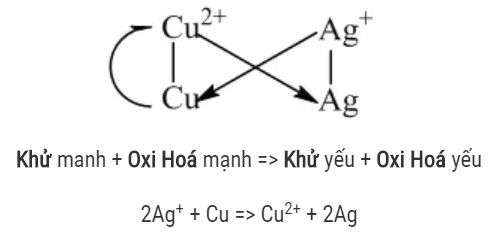
Nêu ý nghĩa dãy điện hoá của kim loại?
Thực tế lượng điện hóa của kim loại rất quan trọng khi bạn phải cân bằng các phản ứng hóa học.
– So sánh oxi hóa – khử
Nghĩa là: Tính oxi hóa của ion Mn+ càng mạnh thì tính khử của kim loại M càng kém và ngược lại.
Ví dụ, sắt Na là chất khử vì ion Na+ là chất oxi hóa yếu. Hay ion K+ là chất oxi hóa mạnh vì sắt K là chất khử yếu.
Xác định nguồn gốc của phản ứng oxy hóa – khử
Dãy điện hóa cũng cho phép bạn dự đoán phản ứng giữa các cặp oxi hóa khử theo định luật Alpha. Trực tiếp: Phản ứng giữa các cặp oxi hóa khử xảy ra trực tiếp, trong đó chất oxi hóa mạnh phản ứng với chất khử mạnh, tạo thành chất oxi hóa và chất khử yếu.
– Xét xem quá trình oxi hóa – khử có xảy ra hay không?
Để xác định xem sự suy giảm oxy có xảy ra hay không, bạn cần biết định luật Alpha. Ý nghĩa: Chất khử + chất oxi hóa mạnh -> Chất oxi hóa mạnh + chất khử yếu.
Tính chất hóa học cơ bản của kim loại
Dựa trên dãy điện hóa, bạn có thể tìm hiểu kim loại được hình thành như thế nào. Vì vậy, giảm tải là một tính chất rất phổ biến của kim loại. Công thức phổ biến nhất là:
M -> Mn+ + ne (với 1≤ n ≤ 3)
xử lý phi kim loại
Một số kim loại có thể phản ứng với phi kim loại, tạo thành muối tương tự. Ngoài ra, các nguyên tố phi kim khác như oxi, lưu huỳnh, clo phản ứng với kim loại tạo thành nhiều muối.
Ví dụ:
- Tác dụng của Nhôm (Al) và Oxy (O): 4Al + O2 -> 2Al2O3
- Tác dụng của Thủy ngân (Hg) với Lưu huỳnh (S): Hg + S -> HgS
- Phản ứng của Sắt (Fe) với Clo (Cl): 2Fe + Cl2 -> 2FeCl3 (kim loại này có hóa trị III)
Phản ứng với dung dịch axit
Nhiều kim loại kết hợp với dung dịch axit để tạo thành muối, giải phóng khí hoặc nước. Tuy nhiên, một số kim loại không phản ứng với axit.
Ví dụ:
- Khi HCl tác dụng với axit H2SO4 loãng, kim loại khử được H+ tạo thành H2. Phản ứng hoá học: Fe + 2HCl -> FeCl2 + H2.
- Đồng (Cu) tác dụng với dung dịch HNO3 sinh ra NO ở thể khí. Phản ứng hóa học: 3Cu + HNO3 -> 3CuSO4 +2NO + 4H2O.
Xử lý nước
Các kim loại nhóm IA và IIA tác dụng với nước tạo thành dung dịch kiềm và khí hiđro.
Ví dụ:
- 2Na + 2 H2O -> 2NaOH + H2 (khí)
Đối phó với phương pháp muối
Khi một kim loại phản ứng với khoáng chất giàu sắt, nó đẩy kim loại ít sắt hơn ra khỏi khoáng chất và tạo ra khoáng chất mới và kim loại mới.
Ví dụ:
- Fe + CuSO4 -> FeSO4 + Cu

Bạn có thuộc lòng danh sách các kim loại điện hóa không?
Để đọc danh sách các kim loại điện hóa, bạn cần hiểu loại kim loại, một phần kiến thức quan trọng trong hóa học hữu cơ. Ngoài ra, hãy nhớ tìm hiểu thêm về âm nhạc điện hóa trong danh sách bên dưới.
| Những bài thơ về nhạc điện tử 1 | Bài 2. Dãy điện hoá của kim loại |
| Dãy điện hóa O sau khi giảm trước khi đến (1) Trả lời bởi alpha. giá trị Nhưng bạn phải hiểu sâu Trước sau như một, mới là thành công Kali, May, Tiên phong Mã, Nhôm, Dân, Kẽm tiếp tục không sợ Sắt rồi đến Niken Niềm tin và ý chí dù muộn màng hãy theo đuổi Hydro, Đồng, Bạc, Thủy ngân, Bạch kim, Vàng cũng mang phần thứ hai. Ba (loại) kim chắc chắn trên đầu Trong phương pháp ngâm nước muối nơi “dừng lại ngay bây giờ”. Không khí bay hơi, muối gặp kiềm, Trao đổi ý kiến là quyền của họ. Một số kim loại rất đơn giản, Muối trước khi bạn bắt đầu đẩy sau. Nếu có thủ đoạn thì nhớ bảo nhau: Việc tháo vòng cộng (H+) không dễ dàng như vậy. Từ Đồng đến cuối hàng, Sau Hydrogen đó, nó không hòa tan chút nào. Đôi lời tâm sự, trao đổi, Điều thú vị nhất khi trồng cây trong “Vườn hóa học” là gì? | – K Na Ba Ca Mg Al Khi Nào Bạn Cần Áo Dài? – Fe Ni Sn Pb H Gửi Ai Trên Phố Hỏi – Cu Hg Ag Pt Au Cửa hàng Châu Á Châu Phi – K Na Li Ba Ca Mg Al Chia tay cơn mưa chiều nay – Mn Zn Fe Co Ni Sn Pb Đôi mắt xưa nhớ thương chờ đợi của Phương -H Cu Bi Hg Ag Pt Au Hỏi nếu bạn biết hoặc đường phố vắng |
Kết thúc
Như vậy, bạn đã hiểu ý nghĩa của dãy điện hóa của kim loại. Trên thực tế, việc siêng năng học hỏi một số mẹo trên sẽ giúp mọi người ghi nhớ thông tin một cách nhanh chóng và dễ dàng.
Bạn thấy bài viết https://daihocdaivietsaigon.edu.vn/day-dien-hoa-cua-kim-loai/ có khắc phục đươc vấn đề bạn tìm hiểu ko?, nếu ko hãy comment góp ý thêm về https://daihocdaivietsaigon.edu.vn/day-dien-hoa-cua-kim-loai/ bên dưới để Trường TH Đông Phương Yên có thể thay đổi & cải thiện nội dung tốt hơn cho các bạn nhé! Cám ơn bạn đã ghé thăm Website: daihocdaivietsaigon.edu.vn của Trường TH Đông Phương Yên
Nhớ để nguồn bài viết này: https://daihocdaivietsaigon.edu.vn/day-dien-hoa-cua-kim-loai/ của website daihocdaivietsaigon.edu.vn
Chuyên mục: Kinh nghiệm hay
Tóp 10 https://daihocdaivietsaigon.edu.vn/day-dien-hoa-cua-kim-loai/
#httpsngonazcomdaydienhoacuakimloai
Video https://daihocdaivietsaigon.edu.vn/day-dien-hoa-cua-kim-loai/
Hình Ảnh https://daihocdaivietsaigon.edu.vn/day-dien-hoa-cua-kim-loai/
#httpsngonazcomdaydienhoacuakimloai
Tin tức https://daihocdaivietsaigon.edu.vn/day-dien-hoa-cua-kim-loai/
#httpsngonazcomdaydienhoacuakimloai
Review https://daihocdaivietsaigon.edu.vn/day-dien-hoa-cua-kim-loai/
#httpsngonazcomdaydienhoacuakimloai
Tham khảo https://daihocdaivietsaigon.edu.vn/day-dien-hoa-cua-kim-loai/
#httpsngonazcomdaydienhoacuakimloai
Mới nhất https://daihocdaivietsaigon.edu.vn/day-dien-hoa-cua-kim-loai/
#httpsngonazcomdaydienhoacuakimloai
Hướng dẫn https://daihocdaivietsaigon.edu.vn/day-dien-hoa-cua-kim-loai/
#httpsngonazcomdaydienhoacuakimloai