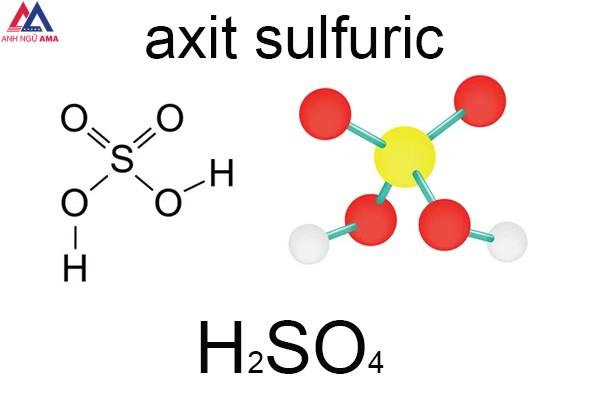
Axit sunfuric là hóa chất thông dụng và được sử dụng rộng rãi nhất trong đời sống con người. H2SO4 là gì? Tính chất vật lý và hóa học của Axit này là gì? Hãy cùng tìm hiểu về H2SO4 ngay sau đây.
H2SO4 là gì?
H2SO4 (Axit Sunfuric) được mệnh danh là vua trong hóa học. Đóng vai trò sống còn trong sự phát triển công nghiệp ngày nay.
H2SO4 là axit thông dụng nhất hiện nay. Nó bao gồm lưu huỳnh (S), oxy (O) và hydro (H). Công thức hóa học của axit này là H2SO4. Tên tiếng anh của H2SO4 là Sulfuric Acid. Axit này còn được gọi là Oil Sulfate và Hydrogen Sulfate.
 H2SO4 là gì?
H2SO4 là gì?
Xem thêm bảng tuần hoàn các nguyên tố hóa học
Tính chất vật lý H2SO4
Cơ thể có thể cô đặc hoặc khử H2SO4 và giống nhau, nó là chất lỏng không màu, không mùi, âm tính, hơi nhớt. H2SO4 khó chuyển động, nặng hơn nước nên ít tan trong nước.
Axit sunfuric rất ưa nước và khi được hấp thụ, nó tạo ra rất nhiều nhiệt. Khi thử chỉ cần cho từ từ H2SO4 vào nước. Đừng làm bất cứ điều gì chống lại điều này vì Axit có thể gây bỏng.
H2SO4 có thể tạo thành hợp chất hữu cơ.
Tính chất hóa học của H2SO4
H2SO4 là một axit rất mạnh, tính ăn mòn của axit này cũng rất quan trọng. Axit sunfuric có thể gây nguy hiểm cho bất cứ thứ gì chạm vào những thứ khác.
Axit sunfuric có độ bay hơi thấp nên đóng vai trò quan trọng trong việc điều chế các axit dễ bay hơi. Do có đặc tính ưa nước nên H2SO4 còn được dùng để làm khô nhiều khí kỵ với axit.
Tính axit của H2SO4 có thể làm quỳ tím hóa đỏ.
Axit sunfuric tồn tại ở hai dạng: axit đặc và axit hòa tan.
 Tính chất hóa học của H2SO4
Tính chất hóa học của H2SO4
Tính chất hóa học của H2SO4 đặc
Trong H2SO4, nguyên tố lưu huỳnh có trạng thái oxi hóa cao nhất +6 của nguyên tố này. Kết quả là, thay vì H2SO4, nó có tính axit mạnh, oxy hóa và ưa nước.
Do có tính axit mạnh nên H2SO4 có thể phản ứng với hầu hết các kim loại (trừ Au và Pt). Axit sunfuric đặc, nóng phản ứng với kim loại tạo thành muối kim loại hóa trị cao, nước và SO2 (H2S, S).
2Al +H2SO4 quá nóng → Al2(SO4)3 + 3SO2 + 6H2O
Cu + H2SO4 quá nóng → CuSO4 + SO2 + 2H2O
2Fe +H2SO4 quá nóng → Fe2(SO4)3 + 3SO2 + 6H2O
3Cr + 4H2SO4 quá nóng → 3CrSO4 + 4H2O + S
H2SO4 nguội sẽ bị nhôm (Al), sắt (Fe) và crom (Cr) thay thế nên không phản ứng được.
Axit sunfuric đặc phản ứng với phi kim tạo thành oxit phi kim, nước và SO2.
S +2H2SO4 quá nóng → 3SO2 + 2H2O
Axit sunfuric đặc nóng phản ứng với các chất khử khác tạo ra muối, nước và SO2.
Nhiệt độ cao H2SO4 + 8HI → H2S + 4I2 + 4H2O
H2SO4 đậm đặc ưa nước
Thí nghiệm: Cho H2SO4 đặc vào cốc đựng nước đường. Nhìn vào tình trạng, chúng ta thấy rằng dòng chuyển sang màu đen với nhọt.
Phương trình giải thích điều này là:
C12H22O11 + H2SO4 → 12C + H2SO4 .11H2O
Tính chất hóa học của H2SO4 khử
Axit sunfuric loãng là một axit mạnh có đầy đủ các tính chất của axit thường như:
– H2SO4 làm quỳ tím hóa đỏ.
– Phản ứng với kim loại, bazơ, oxit của bazơ và khoáng chất để tạo thành các chất quan trọng.
– Axit sunfuric tác dụng với các kim loại có mặt H trừ PB tạo thành muối sunfat:
Fe + H2SO4 → FeSO4 + H2 bay hơi.
– Axit sunfuric tác dụng với oxit bazơ tạo muối mới và nước:
FeO + H2SO4 → FeSO4 + H2O
– Axit sunfuric tác dụng với bazơ tạo muối mới + nước:
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
– Axit sunfuric tác dụng với muối tạo axit mới và muối mới:
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2↑
HCO3 là một axit yếu nên khi tạo thành nhanh chóng chuyển thành H2O và CO2.
Các dạng axit sunfuric (H2SO4)
Tuỳ theo mục đích sử dụng mà H2SO4 có các dạng khác nhau:
- Độ khử của H2SO4 dùng trong phòng thí nghiệm chỉ là 10%.
- Axit sunfuric được sử dụng trong pin chứa khoảng 33,5%.
- Hàm lượng 62,18% thường được dùng trong sản xuất phân bón.
- Trong công nghiệp sản xuất hay axit lượng H2SO4 đã dùng là 77,67%.
- Axit sunfuric đậm đặc có nồng độ 98%.
Tham khảo bảng đơn vị đo khối lượng
Cách điều chế H2SO4
Đốt quặng pirit sắt là một trong những cách phổ biến nhất để điều chế H2SO4; Oxy hóa SO2 qua không khí ở nhiệt độ từ 400 đến 500 độ C; Hoặc hòa tan oleum trong nước vừa đủ để tạo thành H2SO4.
 cách chuyển đổi h2so4
cách chuyển đổi h2so4
Đốt quặng pyrit sắt
FeS2 + O2 → SO2 + Fe2O3
Quá trình oxi hóa SO2 qua không khí ở nhiệt độ 400 – 5000C cần V2O.
SO2 + O2 → SO3
Axit sunfuric H2SO4 hấp thụ SO3 tạo thành oleum
nSO3 + H2SO4 → H2SO4.nSO3
Hòa tan oleum trong nước
H2SO4 .nSO3 + (n+1)H2O → (n+1)H2SO4
Đọc thêm về Hóa học tại Trường Đại học Đại Việt Sài Gòn
Hình ảnh của H2SO4
Axit sunfuric được sử dụng rộng rãi trong nhiều ngành công nghiệp với vai trò là nguyên liệu thô hoặc chất hỗ trợ trong các phản ứng hóa học. H2SO4 được sử dụng rộng rãi trong sản xuất phân bón, chất tẩy rửa tổng hợp, sợi hóa học, chất dẻo và sơn.
Điều chế axit nitric, axit clohiđric trong phòng thí nghiệm
Axit sunfuric được dùng để điều chế axit yếu như HCl, HNO3. Đáp ứng các yêu cầu về thuốc trong phòng thí nghiệm.
H2SO4 trong công nghiệp
Khoảng 160 triệu tấn axit sunfuric được sử dụng hàng năm. H2SO4 được sử dụng phổ biến và rộng rãi trong sản xuất kim loại, sơn, chất dẻo, chất tẩy rửa, giấy và sợi…
H2SO4 là một axit mạnh nên được dùng để tẩy rửa bề mặt kim loại, tẩy rỉ sét.
Sản xuất nhôm sunfat từ H2SO4 là phương pháp tốt nhất. Axit sunfuric còn được dùng trong sản xuất muối sunfat, trước khi sản xuất kim loại trắng, sản xuất thuốc nổ, v.v.
Hỗn hợp H2SO4 và nước được sử dụng rộng rãi trong pin làm chất điện phân.
H2SO4 trong xử lý nước thải
Axit sunfuric được sử dụng trong sản xuất nhôm hydroxit. Sau đó, hydroxit nhôm được sử dụng để lọc tạp chất, cải thiện mùi vị của nước, giúp giảm pH trong nước và loại bỏ các ion kim loại như Mg2+, Ca2+ có trong nước thải. Ngoài ra H2SO4 còn rất nhiều ứng dụng, tác động đến nhiều mặt trong cuộc sống.
Qua bài viết này chúng ta đã biết được H2SO4 là gì, tính chất, cách sản xuất và công dụng của nó. Trường Đại học Đại Việt Sài Gòn muốn gửi đến độc giả những thông tin quan trọng nhất về sản phẩm này.
Bạn thấy bài viết H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4 có khắc phục đươc vấn đề bạn tìm hiểu ko?, nếu ko hãy comment góp ý thêm về H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4 bên dưới để Trường Đại học Đại Việt Sài Gòn có thể thay đổi & cải thiện nội dung tốt hơn cho các bạn nhé! Cám ơn bạn đã ghé thăm Website: daihocdaivietsaigon.edu.vn của Trường Đại học Đại Việt Sài Gòn
Nhớ để nguồn bài viết này: H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4 của website daihocdaivietsaigon.edu.vn
Chuyên mục: Giáo Dục
Tóp 10 H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4
#H2SO4 #là #gì #Tính #chất #các #dạng #và #ứng #dụng #của #H2SO4
Video H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4
Hình Ảnh H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4
#H2SO4 #là #gì #Tính #chất #các #dạng #và #ứng #dụng #của #H2SO4
Tin tức H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4
#H2SO4 #là #gì #Tính #chất #các #dạng #và #ứng #dụng #của #H2SO4
Review H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4
#H2SO4 #là #gì #Tính #chất #các #dạng #và #ứng #dụng #của #H2SO4
Tham khảo H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4
#H2SO4 #là #gì #Tính #chất #các #dạng #và #ứng #dụng #của #H2SO4
Mới nhất H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4
#H2SO4 #là #gì #Tính #chất #các #dạng #và #ứng #dụng #của #H2SO4
Hướng dẫn H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4
#H2SO4 #là #gì #Tính #chất #các #dạng #và #ứng #dụng #của #H2SO4