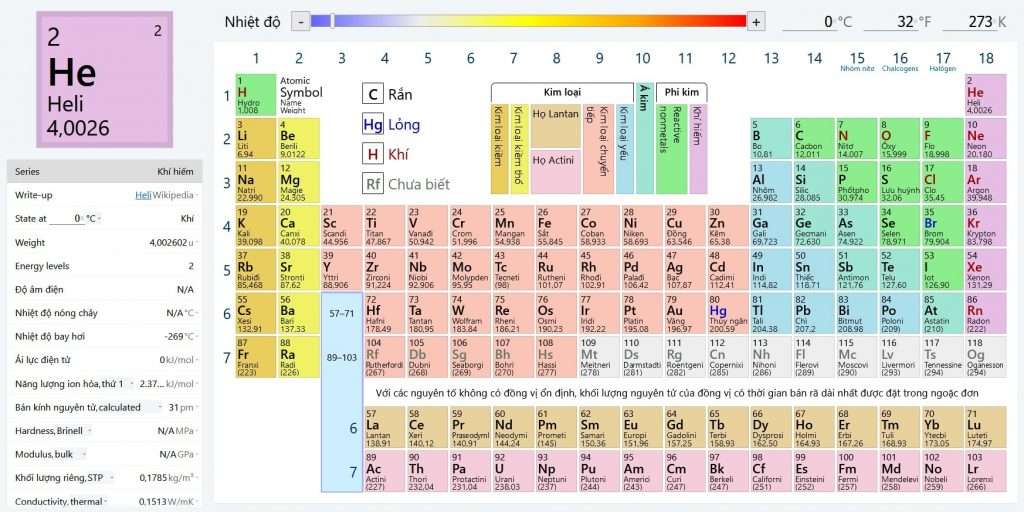
Bảng tuần hoàn hóa học chắc chắn không xa lạ với bất kỳ bạn học sinh nào. Từ thời cấp 2 đến khi lên cấp 3, chúng ta xem hóa trị, các chỉ số đều nhờ nó. Tuy nhiên một số người vẫn chưa hiểu hết được thông tin trong bảng tuần hoàn các nguyên tố hoá học. Để phục vụ tốt nhất việc học hoá các lớp 8, 9, 10, 11, 12, Trường ĐH Đại Việt Sài Gòn đã làm một Bảng Tuần Hoàn Các Nguyên Tố Hoá Học Online có sẵn liên kết trực tiếp với tất cả nguyên tố (giúp hiểu sâu hơn từng nguyên tố), thêm nữa có cả bảng tính tan, dãy điện hoá của kim loại và dãy hoạt động của kim loại rất dễ xem, dễ tìm hiểu sâu về các nguyên tố hoá học nhất có thể.
Lịch sử ra đời của bảng tuần hoàn hóa học
Từ thời xa xưa, chúng ta đã biết đến nhiều nguyên tố hóa học như đồng, vàng, bạc, chì, sắt, thủy ngân,… Đến năm 1869, đã có khoảng 63 nguyên tố được tìm ra.
Vào năm 1862, J. Dobereiner đã có phát hiện quan trọng khi thấy khối lượng nguyên tử của Stronti ở giữa khối lượng nguyên tử của hai nguyên tố Bari và Canxi. Bộ ba nguyên tố này có tính chất tương tự nhau. Sau đó, các nhà khoa học tiếp tục tìm thấy các bộ ba khác với quy luật như trên.
Đến năm 1862, người đầu tiên nghĩ đến việc sắp xếp các nguyên tố hóa học theo chiều tăng của khối lượng nguyên tử lên 1 băng giấy là nhà địa chất Pháp De Chancourtois. Ông thấy tính chất của các nguyên tố giống tính chất của các con số. Tính chất đó lặp lại sau mỗi 7 nguyên tố.
Năm 1864, nhà hóa học người Anh John Newlands tìm ra được quy luật, mỗi nguyên tố hóa học đều thể hiện tính chất tương tự như nguyên tố thứ 8 khi xếp các nguyên tố theo khối lượng nguyên tử tăng dần.
Đặc biệt một dấu ấn quan trọng khác cho ra đời bảng tuần hoàn hóa học, vào năm 1860, nhà bác học người Nga Mendeleev đã lên ý tưởng xây dựng bảng tuần hoàn các nguyên tố hóa học. Sau đó 9 năm, năm 1869, bảng “Bảng tuần hoàn các nguyên tố hóa học” đầu tiên.
Đến năm 1870, nhà khoa học người Đức Lothar Mayer cũng nghiên cứu và cho ra đời bảng tuần hoàn hóa học tương tự như Mendeleev.

Bảng tuần hoàn hóa học có bao nhiêu nguyên tố?
Nếu đang thắc mắc bảng tuần hoàn hóa học có tất cả bao nhiêu nguyên tố thì theo thống kê mới nhất gồm 118 nguyên tố. Bắt đầu từ nguyên tố 1 (Hidro) tới 118 (Oganesson).
Với việc công nhận nguyên tố 113 là nguyên tố hóa học, Liên Minh Quốc Tế về Hóa Học cơ bản và ứng dụng IUPAC chính thức đưa 3 nguyên tố khác lần lượt 115, 117 và 118. Sự cập nhật này cho thấy chu kỳ 7 đã được lấp đầy. Bảng tuần hoàn cũng hoàn thiện hơn giống như khả năng tiên tri cách đây 200 năm của Mendeleev. Kiến thức của nhân loại đã có thêm nhiều bước tiến quan trọng.
Điểm đặc biệt của 4 nguyên tố là 113, 115, 117 và 117 là khả năng tồn tại trong tự nhiên rất thấp, chỉ chưa đến 1 giây trước khi vỡ ra thành nguyên tố khác. Chúng thuộc nguyên tố nặng nhất trong bảng tuần hoàn và chưa từng được thấy tồn tại bên ngoài phòng thí nghiệm.
Kết luận:
– Trong 118 nguyên tố hóa học, có đến 98 nguyên tố xuất hiện trong tự nhiên, 20 nguyên tố còn lại từ Ensteini tới Oganesson, chỉ xuất hiện trong phép tổng hợp nhân tạo.
– Trong 98 nguyên tố tự nhiên, có 84 nguyên tố xuất hiện nguyên thủy khi Trái Đất hình thành. Còn 14 nguyên tố chỉ xuất hiện trong chuỗi phân rã của các nguyên tố trên. Không có nguyên tố nào nặng hơn Einsteini (số hiệu 99) từng quan sát thấy với lượng vĩ mô ở dạng tinh khiết.

Bảng Tuần Hoàn Các Nguyên Tố Hoá Học Mới 2023
Bảng tuần hoàn các nguyên tố hoá học mới nhất 2023 này các bạn nên xem trên máy tính để hiện đầy đủ nhất thông tin!
Cấu tạo của bảng tuần hoàn hóa học
Cấu tạo của bảng tuần hoàn hóa học được chia thành 3 phần chính.
Phần thứ nhất: Ô nguyên tố
Nếu nhìn vào ô nguyên tố, bạn sẽ biết các thông tin như sau:
- Tên nguyên tố:
- Ký hiệu hóa học:
- Số hiệu nguyên tử
- Nguyên tử khối của nguyên tố đó.
Số hiệu nguyên tử có số trị bằng số đơn vị điện tích hạt nhân và bằng số electron trong nguyên tử. Đây cũng là số thứ tự của nguyên tố trong bảng tuần hoàn.
Ví dụ: Số hiệu nguyên tử của Photpho là 15 cho thấy:
- Photpho ở ô số 15
- Điện tích hạt nhân nguyên tử Photpho là 15+ (hay số đơn vị điện tích hạt nhân là 15)
- Có 15 electron trong nguyên tử Photpho
Phần thứ hai: Chu kỳ
Chu kỳ được định nghĩa là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được xếp theo chiều điện tích hạt nhân tăng dần.
Bảng tuần hoàn gồm 7 chu kỳ. Trong đó chu kỳ nhỏ là 1, 2, 3. Còn chu kỳ lớn là 4, 5, 6, 7.
- Chu kỳ 1: Có 2 nguyên tố H và He, gồm 1 lớp electron trong nguyên tử. Điện tích hạt nhân tăng từ H là 1+ đến He là 2+.
- Chu kỳ 2: Có 8 nguyên tố từ Li đến Ne, gồm 2 lớp electron trong nguyên tử. Điện tích hạt nhân tăng từ Li là 3+, … đến Ne là 10+.
- Chu kỳ 3: Có 8 nguyên tố từ Na đến Ar, gồm 3 lớp electron trong nguyên tử. Điện tích hạt nhân tăng dần từ Na 11+, … đến Ar 18+.
- Chu kỳ 4 và chu kỳ 5: Mỗi chu kỳ đều có 18 nguyên tố, bắt đầu là một kim loại kiềm K 19+ và Rb 37+. Kết thúc là một khí hiếm Kr 36+ và Xe là 54+.
- Chu kỳ 6: Có 32 nguyên tố, bắt đầu từ kim loại kiềm Cs 55+ và kết thúc là khí hiếm Rn 86+.
- Chu kỳ 7: Vẫn chưa hoàn thành.
Phần thứ ba: Nhóm nguyên tố
Nhóm nguyên tố là tập hợp nhiều nguyên tố có số electron lớp ngoài cùng bằng nhau. Do đó tính chất tương tự nhau được xếp thành cột theo chiều tăng của điện tích hạt nhân nguyên tử. Số thứ tự của nhóm bằng số electron lớp ngoài cùng của nguyên tử.
Có 2 loại nhóm nguyên tố là nhón A và nhóm B:
– Nhóm A: Gồm các nguyên tố s và p. Số thứ nhóm A = tổng số electron lớp ngoài cùng.
– Nhóm B: Gồm các nguyên tố d và f có cấu hình electron nguyên tử thì tận cùng ở dạng (n-1)dxnsy:
- Nếu (x+y) = 3 -> 7 thì nguyên tố thuộc nhóm (x+y)B.
- Nếu (x+y) = 8 -> 10 thì nguyên tố thuộc nhóm VIIIB.
- Nếu (x+y) > 10 thì nguyên tố thuộc nhóm (x+y-10)B
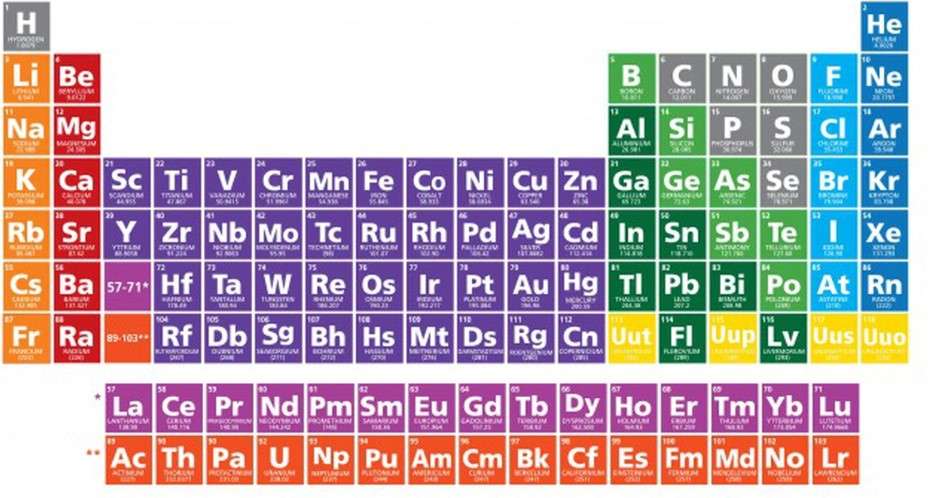
Cách xem bảng tuần hoàn hóa học
Để đọc được bảng tuần hoàn hóa học không hề khó chút nào. Bạn có thể tự mình đọc thành thạo các nguyên tố nhờ thông tin dưới đây.
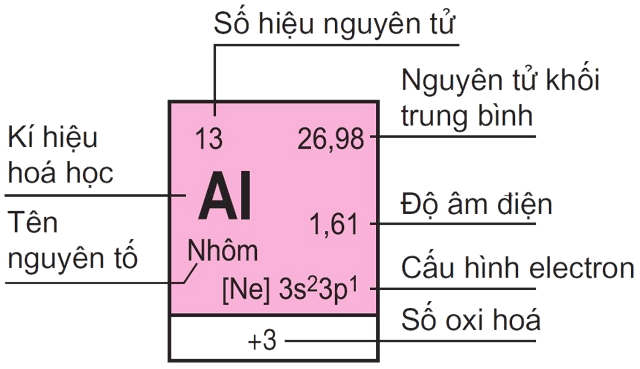
– Tên nguyên tố: Gồm một kiểu nguyên tử, được phân biệt bởi số hiệu nguyên tử, là số lượng proton có trong mỗi hạt nhân.
– Ký hiệu hóa học: Cũng là tên viết tắt của một nguyên tố. Biểu tượng của chúng gồm 1 hoặc 2 chữ cái trong bảng chữ cái Latin, được biết bởi chữ cái đầu tiên viết in hoa.
– Số nguyên tử: Là số proton của nguyên tố hóa học được tìm thấy trong hạt nhân của 1 nguyên tử. Số nguyên tử giúp xác định duy nhất một nguyên tố hóa học. Số nguyên tử cũng bằng số electron trong một nguyên tử trung hòa về điện.
– Số oxi hóa: Là số áp cho một nguyên tử hay nhóm nguyên tử. Nhờ số oxi hóa, bạn biết được số electron trao đổi khi một chất bị oxi hóa hoặc bị khử trong một phản ứng.
– Nguyên tử khối trung bình: Có nhiều đồng vị là nguyên tử khối trung bình của hỗn hợp các đồng vị có tính đến tỷ lệ phần trăm số nguyên tử tương ứng.
– Độ âm điện: Là khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học. Bạn cần nhớ, độ âm điện của nguyên tử nguyên tố càng lớn thì tính phi kim nguyên tố đó càng mạnh và ngược lại.
– Cấu hình electron: Cho biết sự phân bố các electron trong lớp vỏ nguyên tử ở các trạng thái năng lượng khác nhau hay ở các vùng hiện diện của chúng.
Cách học thuộc bảng tuần hoàn hóa học
Bảng tuần hoàn hóa học có tới 118 nguyên tố khác nhau. Việc học thuộc hết tương đối khó. Tuy nhiên bạn vẫn cần nắm bắt những nguyên tố chính thường gặp. Chúng tôi sẽ mách bạn vài cách học thuộc bảng tuần hoàn hóa học nhanh nhất nhé.
Học thuộc bảng tuần hoàn qua cách truyền thống
– Nhận biết các thành phần mỗi nguyên tố: Bạn nên ghi nhớ số nguyên tử, nguyên tử khối, độ âm điện, tên nguyên tố, ký hiệu hóa học,… của những nguyên tố quan trọng.
– Học vài nguyên tố mỗi ngày: Bạn có thể học chậm mà chắc bằng cách ghi nhớ vài nguyên tố mỗi ngày. Nhớ ôn tập lại nguyên tố cũ, tránh trường hợp học cái mới lại quên cái cũ.
– Dán bảng tuần hoàn khắp nơi: Nếu không có nhiều thời gian thì việc dán bảng tuần hoàn cũng rất hiệu quả. Bạn thấy chúng ở mọi nơi trong nhà thì ghi nhớ sẽ dễ dàng hơn.
– Làm thẻ ghi chú cho mỗi nguyên tố: Thẻ ghi chú hay flashcard được đánh giá giúp nhớ kiến thức lâu hơn. Bạn mang chúng đi khắp nơi vừa tiện lại còn dễ ghi nhớ.
– Phân chia thời gian & cách học hợp lý: Mỗi người đều có quỹ thời gian khác nhau. Việc học sẽ hiệu quả nếu bạn chủ động tìm hiểu. Hãy tận dụng mọi thời gian như giờ ra chơi, đi xe buýt,… rèn luyện kiến thức của mình nhé.

Học thuộc bảng tuần hoàn bằng mẹo nhỏ
Mã hóa các chữ cái thành câu nói
- Nhóm IA: Hai, Li, Nào, Không, Rót, Cà, Fe (H, Li, Na, K, Rb, Cs, Fr)
- Nhóm IIA: Banh, Miệng, Cá, Sấu, Bẻ, Răng (Be, Mg, Ca, Sr, Ba, Ra)
- Nhóm IIA: Bố, Ai, Gáy, Inh, Tai (B, Al, Ga, In, Tl)
- Nhóm IV: Chú, Sỉ, Gọi em, Sang nhắm, Phở bò (C, Si, Ge, Sn, Pb)
- Nhóm V: Nhà, Phương, Ăn, Sống, Bí (N, P, As, Sb, Bi)
- Nhóm VI: Ông, Say, Sỉn, Té, Pò (O, S, Se, Te, Po)
- Nhóm VII: Phải, Chi, Bé, Yêu, Anh (F, Cl, Br, I, At)
- Nhóm VIII: Hằng, Nga, Ăn, Khúc, Xương, Rồng (He, Ne, Ar, Kr, Xe, Rn)
Nhớ câu nói quen thuộc
Chắc chắn bạn không xa lạ với câu nói: “Khi nào cần may áo giáp sắt nhớ sang phố hỏi cửa hàng Á Phi Âu”. Trong câu nói này có 16 nguyên tố hóa học quan trọng gồm, F, Na, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au.
Hay câu nói: “Lâu nay không rảnh coi phim” để chỉ 6 nguyên tố nhóm IA: Li, Na, K, Rb, Cs, Pr.
Bài ca hóa trị
Nếu thích vần vè một chút, bạn có thể học thuộc dễ dàng bảng tuần hoàn hóa học nhờ bài ca hóa trị I và bài ca hóa trị II.
| Bài ca hóa trị I | Bài ca hóa trị II |
| Kali (K), iốt (I), hidrô (H) Natri (Na) với bạc (Ag), clo (Cl) một loài Là hoá trị (I) hỡi ai Nhớ ghi cho kỹ khỏi hoài phân vân Magiê (Mg), kẽm (Zn) với thuỷ ngân (Hg) Ôxi (O), đồng(Cu), thiếc (Sn) thêm phần bari (Ba) Cuối cùng thêm chữ canxi (Ca) Hoá trị II nhớ có gì khó khăn! Này nhôm (Al) hoá trị III lần In sâu trí nhớ khi cần có ngay Cácbon (C), silic (Si) này đây Có hoá trị IV không ngày nào quên Sắt (Fe) kia lắm lúc hay phiền II, III rồi sẽ nhớ liền nhau thôi Lại gặp nitơ (N) khổ rồi I, II, III, IV khi thời lên V Lưu huỳnh (S) lắm lúc chơi khăm Xuống II lên VI khi nằm thứ IV Phốt pho (P) nói đến không dư Có ai hỏi đến, thì ừ rằng V Em ơi cố gắng học chăm Bài ca hoá trị suốt năm cần dùng
| Hidro (H) cùng với liti (Li) Natri (Na) cùng với kali (K) chẳng rời Ngoài ra còn bạc (Ag) sáng ngời Chỉ mang hoá trị I thôi chớ nhầm Riêng đồng (Cu) cùng với thuỷ ngân (Hg) Thường II ít I chớ phân vân gì Đổi thay II, IV là chì (Pb) Điển hình hoá trị của chì là II Bao giờ cũng hoá trị II Là ôxi (O), kẽm(Zn) chẳng sai chút gì Ngoài ra còn có canxi (Ca) Magiê (Mg) cùng với bari (Ba) một nhà Bo (B), nhôm (Al) thì hóa trị III Cácbon (C) silic (Si) thiếc (Sn) là IV thôi Thế nhưng phải nói thêm lời Hóa trị II vẫn là nơi đi về Sắt (Fe) II toan tính bộn bề Không bền nên dễ biến liền sắt III Phốtpho III ít gặp mà Photpho V chính người ta gặp nhiều Nitơ (N) hoá trị bao nhiêu? I, II, III, IV phần nhiều tới V Lưu huynh lắm lúc chơi khăm Khi II lúc IV, VI tăng tột cùng Clo (Cl), Iot (I) lung tung II III V VII thường thì I thôi Mangan rắc rối nhất đời Đổi từ I đến VII thời mới yên Hoá trị II dùng rất nhiều Hoá trị VII cũng được yêu hay cần Bài ca hoá trị thuộc lòng Viết thông công thức đề phòng lãng quên Học hành cố gắng cần chuyên Siêng ôn chăm luyện tất nhiên nhớ nhiều |
Chơi các trò trực tuyến
Ngoài giờ học, bạn cũng có thể rèn luyện trí nhớ và giải trí nhờ trò chơi trực tuyến. Điều này được đánh giá vô cùng hữu ích. Một số trang web có ứng dụng trò chơi như: Scratch, Elemental Flash Cards Quiz,…

Download tải bảng tuần hoàn hóa học
Để giúp các em học sinh có thể học tập hiệu quả, chúng tôi đã tổng hợp các file pdf, file ảnh bảng tuần hoàn hóa học rõ nét, đầy đủ nhất lớp 8, lớp 9, lớp 10 bên dưới đây đều sử dụng được. Các em có thể tải bảng tuần hoàn hóa học về để học tập và ghi nhớ:
- Cẩm nang sử dụng bảng tuần hoàn các nguyên tố hóa học (hình ảnh rõ nét)
- Bảng tuần hoàn các nguyên tố hóa học đen trắng bằng Tiếng Anh – Periodic Table of the Elements (pdf)
- Bảng tuần hoàn các nguyên tố hóa học màu Tiếng Anh – Periodic Table of the Elements (pdf)
- Bảng tuần hoàn các nguyên tố hóa học bằng hình ảnh (pdf) (Nguồn: Trương Nguyệt Minh – Phan Phương Đạt).
Bài tập bảng tuần hoàn hoá học vận dụng có đáp án
Học đi đôi với hành, để củng cố kiến thức hơn, các em học sinh nên áp dụng luôn những lý thuyết về bảng tuần hoàn các nguyên tố hoá học trên vào thực tế bài tập của mình.
Bài tập bảng tuần hoàn SGK Hóa 9
Bài 1 Trang 101 SGK Hóa 9
Nêu cấu tạo nguyên tử, tính chất kim loại và tính chất phi kim của các nguyên tố có số hiệu nguyên tử lần lượt là 7, 12, 16.
Lời giải:
Gọi A, B, C là 3 nguyên tố có số hiệu nguyên tử theo yêu cầu đề bài, dựa trên bảng nguyên tố hóa học, ta có bảng sau:
| Nguyên tố | Số hiệu nguyên tử | Cấu tạo nguyên tử | Tính chất | ||||
| Điện tích hạt nhân | Số e trong nguyên tử | Số lớp electron | Số e lớp ngoài cùng | Kim loại | Phi kim | ||
| A | 7 | 7+ | 7 | 2 | 5 | x | |
| B | 12 | 12+ | 12 | 3 | 2 | x | |
| C | 16 | 6+ | 6 | 3 | 6 | x | |
Bài 2 Trang 101 SGK Hóa 9
Cho biết nguyên tố X có cấu tạo nguyên tử với điện tích hạt nhân là 11+, 3 lớp electron, lớp ngoài cùng có 1 electron. Xác định vị trí của nguyên tố X trong bảng tuần hoàn.
Lời giải:
Vị trí của nguyên tố X trong bảng tuần hoàn:
- Ô số 11 (điện tích hạt nhân là 11+)
- Chu kì 3 (3 lớp electron)
- Nhóm I (lớp ngoài cùng có 1 electron)
Từ 3 thông tin trên, ta có thể kết luận:
- Tên nguyên tố X là Natri.
- Ký hiệu hóa học là Na.
- Nguyên tử khối là 23.
Bài 3 Trang 101 SGK Hóa 9
Đặc điểm của các nguyên tố thuộc nhóm I đều là những kim loại mạnh tương tự Natri (có khả năng tác dụng với nước tạo thành dung dịch kiềm giải phóng khí hidro, tác dụng với oxi tạo thành oxit, tác dụng với phi kim khác tạo thành muối). Hãy viết 3 phương trình phản ứng minh họa với Kali.
Lời giải:
- Kali tác dụng với nước tạo dung dịch kiềm và giải phóng khí hidro.
2K + 2H2O → 2KOH + H2
- Kali tác dụng với oxi tạo thành oxit.
4K + O2 → 2K2O
- Kali tác dụng với phi kim tạo thành muối.
2K + Cl2 → 2KCl
Bài 4 Trang 101 SGK Hóa 9
Đặc điểm của các nguyên tố thuốc nhóm VII đều là những phi kim mạnh tương tự Clo (trừ At) (có khả năng tác dụng với hầu hết kim loại tạo thành muối, tác dụng với hidro tạo thành hợp chất khí). Hãy viết 3 phương trình phản ứng minh hoạ với Brom.
Lời giải:
- Brom tác dụng với kim loại tạo thành muối.
Br2 + 2K → 2KBr
3Br2 + 2Fe → 2FeBr3
- Brom tác dụng với hidro tạo thành hợp chất khí
Br2 + H2 → 2HBr (k)
Bài 5 Trang 101 SGK Hóa 9
Hãy cho biết cách sắp xếp nào sau đây đúng theo chiều tính kim loại giảm dần và giải thích sự lựa chọn:
a. Na, Mg, Al, K
b. K, Na, Mg, Al
c. Al, K, Na, Mg
d. Mg, K, Al, Na
Lời giải:
b là đáp án đúng vì
- Các nguyên tố Na, Mg, Al ở cùng chu kì, theo chiều tăng dần điện tích hạt nhân, tính kim loại giảm.
- Các nguyên tố Na, K ở cùng một nhóm, theo chiều tăng điện tích hạt nhân, tính kim loại tăng.
Bài tập bảng tuần hoàn hoá học SGK Hóa 10
Bài 1 Trang 35 SGK Hóa 10
Các nguyên tố xếp ở chu kì 6 có số lớp electron trong nguyên tử là:
a. 3
b. 5
c. 6
d. 7
Lời giải:
c là đáp án đúng.
Bài 2 Trang 35 SGK Hóa 10
Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và số chu kì lớn là:
a. 3 và 3
b. 3 và 4
c. 4 và 4
d. 4 và 3
Lời giải:
b là đáp án đúng.
Bài 3 Trang 35 SGK Hóa 10
Số nguyên tố trong chu kì 3 và 5 là:
A. 8 và 18
B. 18 và 8
C. 8 và 8
D. 18 và 18
Lời giải:
a là đáp án đúng.
Bài 4 Trang 35 SGK Hóa 10
Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo nguyên tắc nào?
a. Theo chiều tăng của điện tích hạt nhân
b. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng
c. Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp thành 1 cột
d. Cả A, B, C
Lời giải:
d là đáp án đúng.
Bài 5 Trang 35 SGK Hóa 10
Tìm câu sai trong các câu sau đây:
a. Bảng tuần hoàn gồm có các ô nguyên tố, các chu kì và các nhóm.
b. Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhận tăng dần.
c. Bảng tuần hoàn có 7 chu kì. Số thứ tự của chu kì bằng số phân lớp electron trong nguyên tử.
d. Bảng tuần hoàn có 8 nhóm A và 8 nhóm B.
Lời giải:
c là đáp án đúng.
Câu đúng: Bảng tuần hoàn có 7 chu kì. Số thứ tự của chu kì bằng số lớp electron trong nguyên tử.
Câu hỏi thường gặp về bảng tuần hoàn
Rất nhiều câu hỏi liên quan đến bảng tuần hoàn các nguyên tố hoá học mà mình thấy nhiều bạn hỏi:
Số hiệu nguyên tử là gì?
Số hiệu nguyên tử của một nguyên tố bằng tổng số hạt proton trong hạt nhân của các nguyên tử của nguyên tố đó. Số nguyên tử có thể cung cấp cái nhìn sâu sắc về cấu hình điện tử của nguyên tố. Ví dụ, cacbon có cấu hình electron là [He] 2s 2 2p 2 , vì số hiệu nguyên tử của nó là 6.
Số hiệu nguyên tử và số khối là gì?
Số proton và số nơtron sẽ xác định số khối của một nguyên tố. Vì các đồng vị của một nguyên tố có số khối hơi khác nhau, nên nó tính khối lượng nguyên tử bằng cách lấy số khối lượng trung bình của các đồng vị của nó.
Hai nguyên tố khác nhau có thể có cùng số hiệu nguyên tử được không?
Các nguyên tử từ hai nguyên tố khác nhau có thể có cùng số nơtron, nhưng không bao giờ có cùng số proton. Số proton là duy nhất của nguyên tố và nó đại diện cho số nguyên tử.
Làm thế nào để chúng tôi tính toán khối lượng nguyên tử?
Thêm khối lượng của proton và nơtron để tính khối lượng nguyên tử của một nguyên tử của một nguyên tố. Ví dụ: Tìm khối lượng nguyên tử của đồng vị cacbon có 7 nơtron. Từ bảng tuần hoàn, bạn có thể thấy rằng cacbon có số nguyên tử là 6, là số proton của nó.
Tại sao số nguyên tử lại quan trọng?
Số hiệu nguyên tử được gọi là số proton trong nguyên tử. Con số này rất quan trọng, vì nó là duy nhất cho các nguyên tử của một nguyên tố nhất định. Nguyên tử của một nguyên tố đều có cùng số proton và mỗi nguyên tố có số proton khác nhau trong nguyên tử của nó.
Kết luận
Như vậy là bạn đã biết các thông tin quan trọng về bảng tuần hoàn các nguyên tố hóa học. Ngoài ra, chúng tôi cũng mách bạn cách ghi nhớ nguyên tố nhanh chóng, chính xác nhất. Hi vọng thông tin trên sẽ giúp mọi người yêu thích môn hóa hơn nhé.
Bạn thấy bài viết Bảng Tuần Hoàn Hóa Học Online Mới Chuẩn Nhất 2023 có khắc phục đươc vấn đề bạn tìm hiểu ko?, nếu ko hãy comment góp ý thêm về Bảng Tuần Hoàn Hóa Học Online Mới Chuẩn Nhất 2023 bên dưới để Trường TH Đông Phương Yên có thể thay đổi & cải thiện nội dung tốt hơn cho các bạn nhé! Cám ơn bạn đã ghé thăm Website: daihocdaivietsaigon.edu.vn của Trường TH Đông Phương Yên
Nhớ để nguồn bài viết này: Bảng Tuần Hoàn Hóa Học Online Mới Chuẩn Nhất 2023 của website daihocdaivietsaigon.edu.vn
Chuyên mục: Kinh nghiệm hay
Tóp 10 Bảng Tuần Hoàn Hóa Học Online Mới Chuẩn Nhất 2023
#Bảng #Tuần #Hoàn #Hóa #Học #Online #Mới #Chuẩn #Nhất
Video Bảng Tuần Hoàn Hóa Học Online Mới Chuẩn Nhất 2023
Hình Ảnh Bảng Tuần Hoàn Hóa Học Online Mới Chuẩn Nhất 2023
#Bảng #Tuần #Hoàn #Hóa #Học #Online #Mới #Chuẩn #Nhất
Tin tức Bảng Tuần Hoàn Hóa Học Online Mới Chuẩn Nhất 2023
#Bảng #Tuần #Hoàn #Hóa #Học #Online #Mới #Chuẩn #Nhất
Review Bảng Tuần Hoàn Hóa Học Online Mới Chuẩn Nhất 2023
#Bảng #Tuần #Hoàn #Hóa #Học #Online #Mới #Chuẩn #Nhất
Tham khảo Bảng Tuần Hoàn Hóa Học Online Mới Chuẩn Nhất 2023
#Bảng #Tuần #Hoàn #Hóa #Học #Online #Mới #Chuẩn #Nhất
Mới nhất Bảng Tuần Hoàn Hóa Học Online Mới Chuẩn Nhất 2023
#Bảng #Tuần #Hoàn #Hóa #Học #Online #Mới #Chuẩn #Nhất
Hướng dẫn Bảng Tuần Hoàn Hóa Học Online Mới Chuẩn Nhất 2023
#Bảng #Tuần #Hoàn #Hóa #Học #Online #Mới #Chuẩn #Nhất